HvJ EU: Ook bescherming zelfs indien de combinatie van werkzame stoffen niet specifiek en precies identificeerbaar in de bewoordingen van de conclusies staan vermeld

HvJ EU 25 juli 2018, IEF 17872; IEFbe 2677; LS&R 1635; C-121/17; ECLI:EU:C:2018:585 (Teva UK e.a. tegen Gilead Sciences) ABC. Octrooirecht. Uit het nieuwsbericht van het Ministerie van Buitenlandse Zaken: de octrooibescherming van een medicijn dat bestaat uit meerdere werkzame stoffen, moet worden beoordeeld vanuit een oogpunt van de vakman naar de stand van de techniek op de datum van indiening of de prioriteitsdatum van dat octrooi. Het EU-Hof volgt met deze uitleg de opvatting van de Nederlandse regering in een Britse zaak over een middel ter bestrijding van HIV. Door deze uitleg zal het middel waarschijnlijk eerder rechtenvrij geproduceerd kunnen worden.
HvJ EU:
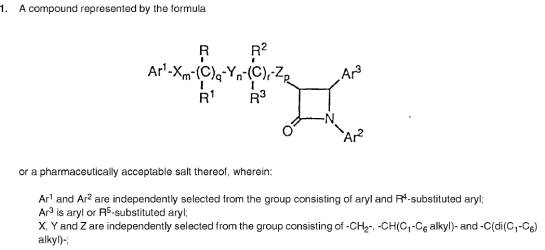
Artikel 3, onder a), van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen moet aldus worden uitgelegd dat een product dat is samengesteld uit meerdere werkzame stoffen met een gecombineerd effect wordt „beschermd door een van kracht zijnd basisoctrooi” in de zin van deze bepaling, wanneer de conclusies van het basisoctrooi noodzakelijkerwijs en specifiek betrekking hebben op de combinatie van de werkzame stoffen waaruit het product bestaat, zelfs indien die combinatie niet uitdrukkelijk is vermeld in deze conclusies. Daartoe is vereist dat uit het oogpunt van de vakman en op basis van de stand van de techniek op de datum van indiening of prioriteitsdatum van het basisoctrooi:
– de combinatie van deze werkzame stoffen, in het licht van de beschrijving en de tekeningen van dit octrooi, noodzakelijkerwijs valt onder de uitvinding waarvoor dat octrooi geldt, en
– elk van deze werkzame stoffen specifiek kan worden geïdentificeerd in het licht van alle door dat octrooi bekendgemaakte gegevens.