30 mrt 2016
Inbreuk op ABC met verlenging volgens weesgeneesmiddelen- en pediatrische verordening
Vzr. Rechtbank Den Haag 30 maart 2016, IEF 15835; LS&R 1290; ECLI:NL:RBDHA:2016:3427 (Novartis tegen Teva c.s.; Imatinib)
ABC. Pediatrische Verordening. Weesgeneesmiddel. Novartis is houdster van ABC NL300086, dat is verkregen na verloop van het basisoctrooi EP0564409, voor de werkzame stof imatinib, wat als weesgeneesmiddel is aangewezen voor de behandeling van chronische myeloïde leukemie. Novartis breidt haar handelsvergunning uit met nieuwe indicatie voor pediatrische patiënten, waardoor de ABC met een duur van zes maanden, ofwel op basis van de Weesgeneesmiddelenverordening, een marktexclusiviteit van twee jaar. Verlenging van de ABC-termijn voor uitgevoerd pediatrisch onderzoek ook mogelijk als geneesmiddel eerder als weesgeneesmiddel aangewezen is geweest. Inbreukverboden worden gegeven.
pediatrische verlenging
4.4. In de Pediatrische Verordening wordt in de daar voorziene beloningen en stimulansen voor door octrooi (of ABC) beschermde producten onderscheid gemaakt tussen geneesmiddelen die al dan niet zijn aangewezen als weesgeneesmiddel. Kort gezegd komt het erop neer dat weesgeneesmiddelen zijn uitgesloten van (het recht op) de in artikel 36 lid 1 van de Pediatrische Verordening voorziene ABC-verlenging met zes maanden. In plaats van de ABC-verlenging krijgen (door octrooi beschermde) weesgeneesmiddelen op grond van artikel 37 van de Pediatrische Verordening een verlenging van de in artikel 8 van de Weesgeneesmiddelenverordening voorziene marktexclusiviteit van 10 jaar naar 12 jaar.
In de verordening is evenwel niet expliciet opgenomen voor welke stimulans geneesmiddelen die in het verleden waren aangewezen als weesgeneesmiddelen in aanmerking komen.4.7.3. De in de considerans vermelde zorgen zijn te terug te vinden in de door de Commissie uitgevoerde marktconsultatie die is neergelegd in de EIA. In de EIA worden ten aanzien van de Pediatrische Verlenging twee zorgen onderscheiden: (i) de zorg dat de ABC-verlenging onmogelijk is voor niet door een octrooi beschermde geneesmiddelen; en (ii) de zorg dat door octrooi beschermde weesgeneesmiddelen een dubbele stimulans krijgen: namelijk ABC-verlenging én marktexclusiviteit.
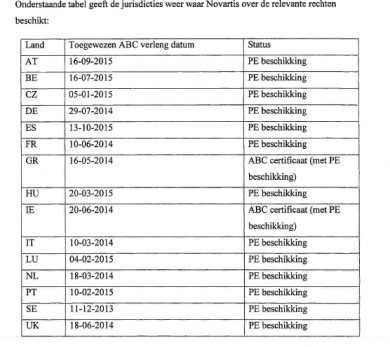
4.8. Gelet op het voorgaande ziet de voorzieningenrechter geen aanleiding om in dit kort geding aan te nemen dat Novartis geen recht had op de Pediatrische Verlenging voor imatinib. Dit geldt niet alleen voor ABC 300086, maar ook voor de in het buitenland verleende parallelle certificaten ten aanzien waarvan Teva Nederland geen zelfstandig verweer heeft gevoerd.
4.10. Gelet op hetgeen dat is overwogen in 4.3 tot en met 4.9 heeft Teva Nederland onvoldoende aannemelijk gemaakt dat de verlenging van ABC 300086 nietig is, althans dat de beschermingsduur ten onrechte zou zijn verlengd. Daarmee moet tot uitgangspunt worden genomen dat de beschermingsduur van ABC 300086 tot 21 december 2016 is verlengd. Daarmee zijn de door Novartis gevorderde (inbreuk)verboden in beginsel toewijsbaar, namelijk voor zover aannemelijk te achten is dat sprake is van een reële dreiging van inbreuk en/of van onrechtmatig handelen. Hetzelfde geldt voor de parallelle ABC’s in de in 2.19 vermelde landen, met dien verstande dat er enige onduidelijkheid bestaat over de precieze einddatum van deze parallelle ABC’s.

















