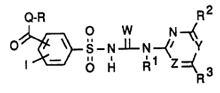Door basisoctrooi beschermd product
HvJ EU 13 juli 2011, Conclusie A-G Trstenjak inzake gevoegde zaken C-322/10 Medeva BV tegen Comptroller- General of Patents, Designs and Trade Marks (Prejudiciële vragen Court of Appeal England and Wales) en C-422/10 Georgetown University, University of Rochester, Loyola University of Chicago tegen Comptroller-General of Patents, Designs and Trade Marks (Prejudiciële vragen High Court of Justice of England and Wales).
 "Verzoek om een prejudiciële beslissing – Court of Appeal (England & Wales) (Civil Division) – Uitlegging van artikel 3, sub a en sub b, van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (PB L 152, blz. 1) – Voorwaarden voor de afgifte van het certificaat – Begrip „door een van kracht zijnd basisoctrooi beschermd product” – Criteria – Bestaan van bijkomende of andere criteria voor een geneesmiddel dat meer dan één werkzame stof bevat of voor een combinatievaccin („multi-disease vaccine”)?"
"Verzoek om een prejudiciële beslissing – Court of Appeal (England & Wales) (Civil Division) – Uitlegging van artikel 3, sub a en sub b, van verordening (EG) nr. 469/2009 van het Europees Parlement en de Raad van 6 mei 2009 betreffende het aanvullende beschermingscertificaat voor geneesmiddelen (PB L 152, blz. 1) – Voorwaarden voor de afgifte van het certificaat – Begrip „door een van kracht zijnd basisoctrooi beschermd product” – Criteria – Bestaan van bijkomende of andere criteria voor een geneesmiddel dat meer dan één werkzame stof bevat of voor een combinatievaccin („multi-disease vaccine”)?"
125. In the light of the foregoing considerations, I propose that the Court answer the questions referred for a preliminary ruling as follows:
A – Questions 1 to 5 of the Court of Appeal (England and Wales) (Civil Division) (Case C-322/10)
1) The condition for the classification of an active ingredient or combination of active ingredients of a medicinal product as a product within the meaning of Article 3(a) of Regulation (EC) No 469/2009 of the European Parliament and of the Council of 6 May 2009 concerning the supplementary protection certificate for medicinal products is that that active ingredient or combination of active ingredients forms the subject‑matter of a basic patent within the meaning of Article 1(c) of that regulation. Whether an active ingredient or combination of active ingredients of a medicinal product forms the subject‑matter of a basic patent within the meaning of Article 1(c) and whether that active ingredient or combination of active ingredients is protected by a basic patent in force in accordance with the requirement of Article 3(a) are determined, in principle, according to the rules governing the basic patent. However, the definition of the basic patent laid down in Article 1(c) of the regulation precludes use of the protective effect of the basic patent from being invoked as a criterion for the purpose of answering the question whether an active ingredient or combination of active ingredients of a medicinal product forms the subject‑matter of a basic patent.
2) In the context of the assessment of a supplementary protection certificate application relating to a medicinal product with multiple active ingredients or to a multi‑disease vaccine, there are no further or different criteria for determining whether a product within the meaning of Article 3(a) of Regulation No 469/2009 exists and whether that product is protected by a basic patent in force.
3) The questions whether a multi‑disease vaccine can be classified as a product within the meaning of Article 3(a) of Regulation No 469/2009 and whether that product is protected by a basic patent in force where only one of its active ingredients or each of its active ingredients against one of the diseases is protected by a basic patent in force must, in principle, be answered according to the rules governing the basic patent. However, the protective effect of the basic patent must not be used as a criterion for the purpose of answering the question whether a product within the meaning of Article 3(a) of the regulation exists.
B – Sixth question of the Court of Appeal (England and Wales) (Civil Division) (Case C-322/10) and sole question of the High Court of Justice of England and Wales Chancery Division (Patents Court) (Case C-422/10)
4) A valid authorisation to place the product on the market as a medicinal product within the meaning of Article 3(b) of Regulation No 469/2009 exists for a single active ingredient or combination of active ingredients where that active ingredient or combination of active ingredients is contained together with one or more other active ingredients in a medicinal product which was the subject of a valid marketing authorisation granted in accordance with Directive 2001/83/EC or Directive 2001/82/EC.
 Prejudiciële vragen gesteld door het Bundespatentgericht, Duitsland.
Prejudiciële vragen gesteld door het Bundespatentgericht, Duitsland. Prejudiciële vragen High Court of Justice, Verenigd Koninkrijk.
Prejudiciële vragen High Court of Justice, Verenigd Koninkrijk. Uitspraak ingezonden door Marjanka Vermunt,
Uitspraak ingezonden door Marjanka Vermunt,  Octrooirecht. Geëxpireerd EP 0 334 429 /
Octrooirecht. Geëxpireerd EP 0 334 429 /  Prejudiciële vragen gesteld door het Bundespatentgericht, Duitsland.
Prejudiciële vragen gesteld door het Bundespatentgericht, Duitsland. Octrooirecht. Bodemprocedure, volgend op KG Merck / Sandoz (vzr. Rechtbank ‘s-Gravenhage, 4 juni 2010,
Octrooirecht. Bodemprocedure, volgend op KG Merck / Sandoz (vzr. Rechtbank ‘s-Gravenhage, 4 juni 2010,  Uitspraak ingezonden door Anke Heezius,
Uitspraak ingezonden door Anke Heezius,  Prejudiciële vragen gesteld door Lietuvos Aukščiausiasis Teismas, Litouwen.
Prejudiciële vragen gesteld door Lietuvos Aukščiausiasis Teismas, Litouwen.